付記
紙が形を保ち、強さを保持しているのは、繊維(一般に細い糸状の物質)間の絡み合いによる機械的な力だけでなく、セルロース分子間に水素結合という化学力が働いて繊維同士が引き合っているからです。この化学的な力が働いて繊維同士が引き合って紙が形成されますが、これは抄紙機のワイヤーパートからドライヤーパートの過程でできあがります。
この場合の水素結合は、セルロース分子内にある多数の親水性である水酸基(ヒドロキシル基、OH基)の酸素原子が余分の電子を持って、他から水素原子核を引き付けるために起きます。そして近くにある水酸基間で、相互に水素を介した酸素の結合(水素結合-O-H…O<)ができあがります。図1にセルロースの構造式を掲げます。
図1.セルロース構造式
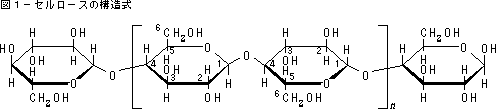
セルロースは繊維素[(C6H10O5)n]ともいい、単糖類であるブドウ糖[(C6H12O6)、D‐グルコース glucose] が連結(重合)した長い鎖状の高分子です。
なお、ブドウ糖は遊離の状態で甘い果実の中に多量に存在し、動物体内には、血液、脳脊髄液、リンパ液中に少量含まれるが、糖尿病患者の尿中には多量にみられます。麦芽糖、ショ糖、乳糖などの二糖類の構成糖であるほか、デンプン・グリコーゲン・セルロースなどの多糖および各種配糖体の基本単位です[平凡社発行 世界大百科事典(第2版 CD-ROM版)から抜粋]。
参考
D-グルコース(ブドウ糖 glucose)について
D-グルコースは天然に遊離の形で存在し、ほのかに甘く、あらゆる生物にとって最も重要な栄養源です。D-グルコース分子は結晶状態では全て環状構造(ピラノース型)をとっています。結晶を作る条件により、a型とb型が生じます。D-グルコースを水に溶かすと、鎖状構造を介してa型とb型が生じ、最終的にこの3つの分子種の平衡混合物になります。
図2にグルコースの構造式を示します。
図2.グルコース分子の構造式
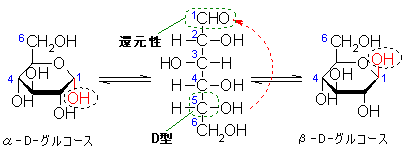
a-D-グルコースはデンプン、b-D-グルコースはセルロースの成分です。D-グルコース分子を鎖式構造で記すと右図の中央のようになります。1位の炭素はアルデヒド基なのでグルコースは還元性を示す。D-グルコースのD型はC5炭素の立体配座で決めまります。
D-グルコースは水溶液中で鎖状構造以外に、環状構造(ピラノース型)をとって存在します。環状構造をとった場合、C1炭素は不斉炭素原子になり、新しい異性が生じます。これをアノマーといい、α型とβ型で表します。環状構造をとるとC5炭素のヒドロキシル基がエーテル基に変化するとともに、C1炭素に新しいヒドロキシル基が生じます。このヒドロキシル基はアルデヒド基から派生したものなので、還元性を示す原因となります。このようなヒドロキシル基をグリコシド性ヒドロキシル基という(図の破線で囲んだOH)(ホームページ糖質から抜粋)。
繊維細胞の主成分であるセルロース(cellulose)[繊維素(C6H10O5)n]は、数千個(500~6000個) ものグルコース[ブドウ糖(C6H12O6)]の単糖類が連結(重合)した長い鎖状の高分子(ポリマー)で、もとは二酸化炭素(炭酸ガスCO2)と水(H2O)とが、葉緑素の触媒作用で太陽光線のエネルギーを得て光合成された化合物です。
いろいろな長さ(重合度)のセルロース分子は、集合してミクロフィブリル[糸状の形態をしているセルロース分子の集合単位]を形成し、さらにこれが他のヘミセルロースやリグニンなどの化合物と複雑に絡み合って繊維細胞を構成しています。
長い高分子が集合するとき、整然とならんだ結晶領域と、不規則な非結晶領域(無定形部分)とができます(図3および図4参照)。図3にセルロースの構造を掲げます(中嶋隆吉、“紙 一紙と印刷、品質クレームへの対応一(上巻 増補改訂版)"(1997年12月)、王子製紙株式会社発行参照)。
図3.セルロースの構造
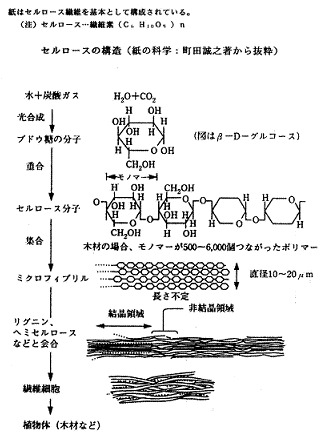
ブドウ糖が水によく溶けるのに対し、セルロースは強固な結晶構造を持っているため、水の無定型部分への侵入によって繊維が膨潤することはあっても、水に溶けることはありません。 なお、重合度および結晶領域の割合(結晶化度といいます)が高いほど、繊維は丈夫となります。また、紙が形を保ち、強さを保持しているのは、繊維の絡み合いによる機械的な力だけでなく、セルロース分子間に水素結合という化学力が働いて繊維同士が引き合っているからです。この場合の水素結合は、分子内の多数の親水性の水酸基(ヒドロキシル基、OH基)の酸素原子が余分の電子を持って、他から水素原子核を引き付けるために起きます。近くにある水酸基間で、相互に水素を介した酸素の結合(水素結合 -O-H…O<)ができます。その結合力は通常の化学結合(共有結合)よりは弱いのですが、長い高分子が無数の水素結合を行うと全体では強い力となります(図4参照)。
水素結合とは分子間結合の1つで、その結合力は普通の化学結合より弱く、分子間力による結合より強く、その強さは約5kcal/molであり、分子内の共有結合O-H(約100kca/mol)と分子間に働くファンデルワールス結合(約0.5kcal/mol)の大体中間にあります。このように水素結合の結合力は通常の化学結合(共有結合)よりは弱いのですが、長い高分子が無数の水素結合を行うと全体では強い力となり、紙になるときに、この水酸基はシートを形成して強度を発現させるという重要な役目を果しています。
水素結合が多くあると強い力になります。しかも、適度に乾燥した状態のときにはある程度の結合力を持つようになり、他の結合よりも多いこともあって、紙の強度を保つためには大切なものです。しかし、水の介入によって水素結合は簡単に切断され、結合は弱まりバラバラになります。ちなみに、氷は水分子同士が水素結合という弱い結合でつながってできた結晶です。
紙になるときに、この水酸基はシートを形成して強度を発現させるという重要な役目を果しています。すなわち、紙製造の段階で紙料から脱水の過程でセルロースが接近しますと水の表面張力で繊維同士が接近し、さらに水が蒸発にするにしたがってますます繊維が引き寄せられます。例えば、ドライヤーなどで乾燥しますと、次第に水が蒸発して繊維同士が接近してくるわけですが、接近しますと水酸基と水酸基の間で、水素結合と呼ばれる結合が発生し、これが紙の強度を高めるわけです。このように接着剤を使わなくてもセルロースの水酸基のために自己接着性が発生するというわけです。そして乾燥を受けると水和していたセルロースから水が除かれて繊維本来の柔軟な硬さにもどり、弾性を持った紙の組織ができ上がります。これが製紙の原理です。ところで、水分子(H2O)自身も水素結合しやすく、セルロース中の親水性の基である水酸基ともすぐに結びつきますが、これを水和といいます。つまりセルロースの親水性は本質的なもので、吸湿性あるいは吸水性は紙の宿命であると言えるわけです。
それでは図4にフィブリル化とセルロース繊維および水素結合の模式図を示しますが、フィブリル化とは繊維内部のフィブリル(小繊維)が、摩擦作用で表面に現れて毛羽立ちささくれる現象をいいます。セルロース系繊維はすべて、フィブリルが多数集まった束であり、各フィブリルの間には微細な空気溝(孔)がありまする。この空気溝(孔)の数、大きさ、配向性がフィブリル化に影響を与えますが、通常ではフィブリル間には水素結合や分子間力が働くためフィブリルは結束されていますが、外力、特に湿潤状態で摩擦が加わるとフィブリル間にあった空気溝(孔)に沿って裂けます。
図4.フィブリル化とセルロース繊維および水素結合

原料調成段階では、主成分である数千個つながった高分子物質のセルロース(繊維)は水によりばらばらにほぐされた状態にあり紙として強度を持つことはできていません。それが抄紙の段階で脱水されることによって、図に示すようにセルロース分子の分子端が水素結合して結びつき、紙という状態を維持することができるようになります。決して繊維を何らかの接着剤によって結合しているわけではなく、水素結合で結びつき紙力ができ、紙が形成されるわけです。この水素結合を起こしやすくするための原料調成工程で叩解(こうかい/Beating)を行いますが、叩解は繊維を水で膨潤させ、繊維が切れないようにすり潰してささくれ立った細い糸状体を発生させるように行います。これがフィブリル化であり、後工程のワイヤー(抄き網)上で水の表面張力で結合していたセルロース繊維は、乾燥とともにフィブリルの終端の[-H][-OH]が水素結合することで紙としての強さを持つようになります。この結合形態は周囲の湿度の影響も受けて、セルロース分子同士の直接の結合や、間に水の原子を介在させた結合が入り混じったものであり、結合力自身は化学結合よりは小さいが、ファン・デル・ワールス力よりは大きい(ホームページ紙の歴史と製法から抜粋)。
参考
- 共有結合…二つの原子が、二つの電子を1対として共有することによって生ずる化学結合。例えば、水素分子(H2)における水素原子(H)の結合で、電子対結合ともいいます。
- ファンデルワールス結合…分子間に働く引力で、いくつかの原子が共有結合によってできた分子はお互いに弱い力で引き付けあっています。この弱い力のことを分子間力、またはファンデルワールス力といいます。
- イオン結合…塩化ナトリウム(Nacl)などにおける結合で、陽イオンと陰イオンとの間の静電引力に基づく化学結合をいいます。
- 金属結合…金属内での原子間の結合のことで、自由電子を媒介として、陽イオンとなった金属原子が結びつきます。